т. 20, № 2, стр. 100-113 (1994)
Реакция окси- и аминоацильного включения
А.М. Шкроб
Институт биомедицинской химии РАМН, Москва
|
т. 20, № 2, стр. 100-113 (1994) |
| © А.М. Шкроб |
Реакция окси- и аминоацильного включенияА.М. Шкроб Институт биомедицинской химии РАМН, Москва |
Человечество возникло и имеет шанс уцелеть благодаря своей способности передавать от поколения к поколению накопленный рациональный и нравственный опыт. И если в ветхозаветное время этот опыт люди приобретали главным образом в семье, то уже не одно тысячелетие вместе с родителями или после них нас воспитывают учителя. Чти родителей и учителей своих! - таков глубинный смысл едва ли не главной из заповедей, переданных Моисеем своему народу.
В апогее смуты, которую метко назвали схваткой реакции с контрреволюцией, воспоминания об учителях - достойных людях и прекрасных ученых - помогают нам сохранить, по мере сил умножить и передать дальше (и не обязательно фонду Сороса) все то, что мы получили из их рук. Именно в этом смысл сегодняшнего нашего собрания, посвященного памяти В.К. Антонова.
Когда-то А.Н. Несмеянов заметил, что наука ничего общего не имеет с нравственностью. Так это или нет, но подлинная наука произрастает только в сообществах, где нравственность не упала ниже некоторого критического уровня. Молодым людям, подобно мне пришедшим в 1959-1960 гг. в только что родившийся Институт химии природных соединений, довелось работать под началом М.М. Шемякина, Н.К. Кочеткова, И.В. Торгова, М.Н. Колосова, В.М. Степанова, В.К. Антонова... Далеко не всякий решится при таких руководителях на какую-нибудь пакость. Но их основную нравственную заслугу я вижу в том, что нам предоставили возможность не "лепить" диссертации для себя и начальства, а самостоятельно продвигаться в совершенно девственных по уровню направлениях и, опираясь на знания и доброжелательную поддержку своих учителей и коллег, сознательно участвовать в создании новой науки - биоорганической химии. Тем, кто привык к стилю "нам не нужны поиски, нам нужны находки", трудно представить, как хорошо работалось в те годы.
Любое исследование несет на себе отпечаток личности ученого и современной ему эпохи, но углядеть его не всегда просто, не всегда безопасно и почти всегда кажется не очень нужным. Сегодня, обращаясь к работам, выполненным под руководством М.М. Шемякина и В.К. Антонова в 60-е годы, я хочу использовать редкую возможность соединить рассказ о том, что было сделано, с воспоминаниями о том, как это делалось. Это, надеюсь, будет сага не столько о циклолах и депсипептидах, сколько о том, каким путем В.К. Антонов пришел в энзимологию и на какой основе сформировался характерный для него стиль исследования.
* * * Сейчас уже мало кто помнит разработанныe в лаборатории М.М. Шемякина методы синтеза производных альфа-окси-альфа-аминокислот (I) [1-6]. Вскоре целая гроздь этих, ранее почти недоступных соединений оказалась в руках исследователей, и они, естественно, задумались о том, как эти вещества использовать. Одним из путей было их применение в качестве аналогов окси- и аминокислот - и отсюда родился интерес Шемякина к пептидам и депсипептидам [7]. Другой же путь связан с алкалоидами спорыньи - чуть ли не единственными природными соединениями, содержащими остатки альфа-окси-альфа-аминокислот. Подумать о строении и возможности синтеза этих алкалоидов было поручено Г.А. Равдель и В.К. Антонову. Так был совершен первый шаг в тогда еще зыбкую и мало изученную область науки - химию ортоамидов.
Ортоамидами называют соединения, содержащие тетраэдрические группировки, которые возникают в результате нуклеофильного присоединения к амидным карбонилам воды, спиртов, аминов или амидов (II <-->III). Лишь крайне редко такие соединения устойчивы (например, аддукты спиртов и трифторацетамида [8]), а большей частью они образуются как метастабильные промежуточные продукты в реакциях гидролиза, алкоголиза или аминолиза амидов (III). Реальность таких интермедиатов была доказана Бендером, наблюдавшим внедрение 18O в СО-группы при частичном гидролизе амидов и эфиров в Н 218О (IV<--> V <-->VI) [9].
Некоторые исследователи полагали, что ортоамиды играют важную роль в белках. Так, например, Дороти Ринч, следуя Франку [10], многие годы настойчиво доказывала, что полипептидные цепи в белках скреплены ортоамидными мостиками (VII) [11]. Возникающие при этом гипотетические структуры она назвала циклолами. Этот термин прижился, и циклолами стали потом называть любые продукты внутримолекулярного нуклеофильного присоединения к амидной группе. Ринч полагала, что благодаря возникновению и распаду циклолов белки представляют собой динамические образования, подверженные постоянным перестройкам и флуктуациям, внешне похожим на своего рода кроссинговер.
Большая монография Ринч о пептидных и белковых циклолах вышла в 1960 г. [12], но она уже воспринималась современниками как курьез, наподобие дикетопиперазиновой теории Зелинского-Гаврилова. Фишеровская концепция полипептидной структуры белка стала общепринятой; к тому же еще до войны Полинг и Ниман [13] показали, что образование ортоамидов термодинамически невыгодно, так как сопровождается исчезновением характерного для амидной группы p"пи"-сопряжения. Позже Эдвард [14] справедливо заметил, что ортоамиды все же могут оказаться устойчивыми, если локальный проигрыш в энергии при образовании собственно ортоамидной группировки компенсируется при сопутствующей конформационной перестройке молекулы в целом. Такие компенсаторные эффекты нередко проявляются при трансанулярных реакциях в средних циклах.
В этой связи не было ничего безумного в той странной циклольной структуре (VIII), которую Бернхард [15] приписал аспартилсериновому дипептиду в активном центре химотрипсина. Впрочем эта гипотеза вскоре была опровергнута. Такая же судьба постигла и некоторые другие гипотетические циклолы, и только два класса соединений реально претендовали на роль стабильных циклолов. К первому принадлежали алкалоиды группы ретсинина - они предположительно были азациклолами (IX) [16-20]. Оксациклольную структуру (X) после долгих дискуссий большинство исследователей, следуя Штоллю [21], приписывало пептидной части алкалоидов спорыньи: эрготамину, эргокристину и др.
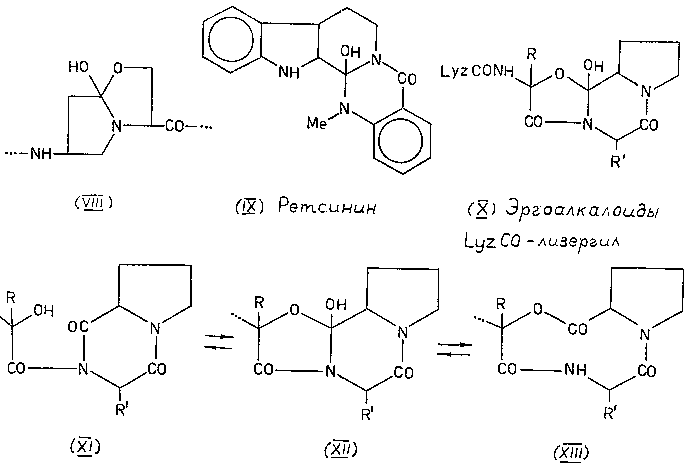
* * * В 50-е годы физико-химические методы: ИК- и УФ-спектроскопия, рентгеноструктурный анализ (тем более КД, ЯМР и масс-спектрометрия) - еще сравнительно редко применялись для установления строения сложных природных соединений. Обычно оно выводилось из сопоставления структуры продуктов расщепления данного вещества под действием разных агентов. В случае эргоалкалоидов трудность заключалась в том, что при одном типе расщепления строение продуктов лучше всего согласовывалось с ацилдикетопиперазиновой структурой материнского соединения (XI), тогда как при другом - с макроциклической (XIII) [22-27]. Интересно, что данные, которые, как казалось, особенно убедительно доказывали циклольную структуру (XII), позднее были признаны ошибочными.
Шемякину было присуще стремление, скорее даже страсть, к более чем тщательному обдумыванию и обсуждению предмета предстоящего исследования. Мне доводилось слышать из высокопоставленных уст рассуждения о "шемякинских говорильнях". Между тем многие семинары тех лет остались в памяти как образцовый пример brain attaques и отличная школа для молодежи. И в нашем случае продолжительные споры привели к блестящему результату. В 1960 г. Шемякин и его коллеги на симпозиуме в Базеле выдвинули довольно еретическую гипотезу [28]. Они предположили, что "ацилдикетопиперазиновые" и "макроциклические" продукты расщепления эргоалкалоидов образуются не из циклолов (XII), способных распадаться по разным направлениям, а из реально существующих N-оксиацилдикетопиперазинов (XI) и девятичленных циклодепсипептидов (XIII), в которые циклолы (XII) могут обратимо превращаться. Подробнее об этом было сказано во вскоре опубликованной статье Шемякина, Равдель, Крит и Щукиной [29].
Эта гипотеза оказалась на редкость продуктивной. Прежде всего, ее можно рассматривать как пример удачного ретросинтетического анализа. В самом деле, стало ясно, что существуют два независимых подхода к синтезу эргоалкалоидов - один, основанный на изомеризации оксиацилдикетопиперазинов (XI), и другой, включающий трансанулярную реакцию в девятичленных циклотридепсипептидах (XII) (кстати, сам термин "депсипептид" тогда только что родился; я слышал, что его предложил А.С. Хохлов). Оба эти подхода вскоре были реализованы Гофманом в Швейцарии [30] и Шеппардом в Англии [31]. Далее, чтобы обнаружить изомерные или таутомерные превращения, необходимо иметь спектральные характеристики индивидуальных форм. Получить такие данные с самими эргоалкалоидами практически невозможно, и, тем самым, проблема перемещается на синтез и тщательное изучение модельных соединений. И наконец, еще один, может быть главный, аспект. Если из предложенной схемы превращений вычленить реакцию оксиацилдикетопиперазин --> оксациклол -->циклодепсипептид, то она представляет собой не что иное, как способ вставить остаток оксикислоты в пептидную цепь, основанный на N-ацилировании амидной группы (XIV -->XV --> -->XVI). Это был совершенно новый синтетический путь к депсипептидам, реальность и универсальность которого следовало немедленно и направленно проверить.
Сейчас кажется удивительным, что этот синтетический аспект гипотезы не привлек должного внимания ее авторов. Можно апеллировать к публикациям, рукописям или к чудом сохранившимся записям семинаров, но лучше всего об этом свидетельствует недоумение, сменившееся подлинно детским восторгом, когда на включение оксикислоты в пептид, наконец, наткнулись и только тогда оценили открывшиеся возможности. Эту реакцию можно было обнаружить гораздо раньше и на менее экзотическом примере, но, что было, то было. Теперь, задним числом, видно, как эффектно можно было использовать эту идею при синтезе валиномицина, столь блистательно осуществленном Е.И. Виноградовой с сотр. в те же годы и в той же шемякинской лаборатории [32].
* * * Впрочем, важно другое. Научные идеи, лежавшие в основе гипотезы Шемякина и его коллег, выходили далеко за пределы узкой проблемы установления строения и синтеза эргоалкалоидов, открывая простор для поиска ранее неизвестных изомерных и таутомерных превращений. Вот почему сообщение о полном синтезе эрготамина, выполненном Гофманом в 1961 г. [30,33], не остановило, а стимулировало исследования в ИХПС. К тому же в этом сообщении не было главного - основанного на строгих физико-химических данных доказательства циклольной структуры. Забегая вперед, замечу, что необходимые данные группа Гофмана опубликовала спустя год [34,35] после того, как Антонов представил их на пептидном симпозиуме в Оксфорде [36] (между нами говоря, этот доклад прочел другой человек - Антонова в Англию не отпустили).
От рассуждений пора было переходить к эксперименту. Г.А. Равдель и Н.А. Крит занимались синтезом модельных девятичленных циклодепсипептидов, но встретили так и не преодоленные трудности на стадии циклизации. Однако к этому времени в исследования включился и В.К. Антонов, который с небольшой группой сотрудников приступил к поиску изомерных переходов между оксиациламидами и соответствующими им оксациклолами. Основные результаты были получены уже через год.
Прежде всего удалось найти тот самый спектральный критерий, который был необходим для доказательства циклольной структуры эргоалкалоидов [36-38]. Оказалось, что два из синтезированных оксиацилдикетопиперазинов (XVII и XIX) в растворах находятся в таутомерном равновесии с соответствующими циклолами (XVIII и XX), причем циклол (XX) был выделен в кристаллическом состоянии. Иными словами, стало возможным приходить к равновесному состоянию с обеих сторон, просто растворяя кристаллический циклол (XX) или оксиацилдикетопиперазин (XVII). Это значительно упростило поиск спектральных критериев изомеризации. Их было найдено два. Во-первых, за циклолообразованием можно следить по уменьшению поглощения ациламидных хромофоров. Увы, этот метод неприменим к эргоалкалоидам, где много других хромофоров, поглощающих в той же области (215-220 нм). Во-вторых, и это было неожиданно, карбонилы оксикислотного остатка в ацилдикетопиперазинах и циклолах имеют практически одинаковые полосы в ИК-спектрах, зато карбонильная полоса периферической (пиперазиновой) амидной группы при циклолообразовании претерпевает заметный батохромный сдвиг (1695 -->1670 см-1). Именно этот сдвиг, характерный и для эргоалкалоидов, позволил, наконец, подвести черту под полувековой историей установления их строения.
Лишь на первый взгляд кажется, что эта удача была случайной. В лаборатории Гофмана с той же целью синтезировали не один аналог пептидной части эргоалкалоидов, но так и не нашли среди них способных к таутомерии. Дело в том, что швейцарцы старались как можно меньше отходить от материнских соединений (см., например, соединение (XXI) [33]), тогда как Шемякин исповедовал диаметрально противоположный подход. Я навсегда запомнил его доклад на Менделеевском съезде в 1958 г., в котором он призывал при моделировании физиологически активных соединений стремиться к максимальному упрощению молекулы, отыскивая тот порог, те структурные особенности, которые являются ключевыми для данного биологического (и любого другого) эффекта. Сохраняя размеры и конфигурацию боковых цепей, Гофман и его коллеги автоматически сохраняли действующими структурные предпосылки, которые способствовали закреплению циклольной формы и, тем самым, исключали таутомерию.
Это стремление к упрощению естественно привело от оксиацилдикетопиперазинов к оксиациллактамам [36,37,39,40]. Именно на этих соединениях была в полной мере продемонстрирована правильность Базельской гипотезы и с максимальной, я бы сказал хрестоматийной, четкостью выявлены все факторы, контролирующие взаимные превращения изомеров в ряду оксиациламид - оксациклол - амидоэфир. Их оказалось не так уж много.
* * * Начнем с образования циклолов из оксиациламидов. В ациламидах положительный заряд на карбонильных С-атомах заметно выше, чем в амидах, и потому они относятся к активированным амидам, особенно склонным к реакциям нуклеофильного присоединения (ср. [41]). Именно это обстоятельство определяет спонтанный характер всех изомеризаций оксиациллактамов. С образованием циклола в лактамном кольце изменяется геометрия, число и объем заместителей у одного из атомов. Возникающие при этом стерические затруднения могут быть достаточно велики, чтобы циклолообразование стало термодинамически невыгодным. По этой причине, например, оно не происходит у N-гликолилпирролидона (XXII) (ср. [42-44]).
В общем случае циклолы, образующиеся из оксиациламидов, являются метастабильными структурами, склонными изомеризоваться в амидоэфиры - термодинамически наиболее устойчивые из всех трех изомеров. Такая изомеризация, однако, не происходит, если она приводит к пространственно затрудненным, в частности к девятичленным, циклам. Вот тут-то и возникает своего рода "экологическая ниша", в которой могут существовать стабильные циклолы, в том числе эргоалкалоиды!
Вот особенно наглядные примеры к сказанному. Превращение N-гликолилвалеролактама (XXIII) в девятичленный лактонолактам замораживается на стадии циклола (XXIV), который можно легко выделить в кристаллическом состоянии и охарактеризовать в виде О-метильного производного. Напротив, N-З-оксипропионилвалеролактам (XXV) гладко изомеризуется в десятичленный лактонолактам (XXVI). Именно это превращение и было первым случаем, когда оксикислотный остаток удалось просто и изящно включить в пептид.
Остановка превращения на стадии циклола связана не со структурой оксикислотного остатка, а исключительно с геометрией и размерами кольца терминального лактонолактама. Так, превращения N-гликолилкапролактама ограничены его таутомерией с циклолом, тогда как N-гликолилдодекалактам (XXVII) полностъю превращается в 15-членный лактонолактам (XXVIII). Кстати, это редкий случай, когда для определения строения вещества его достаточно понюхать. Подобно макроциклическим лактонам вроде экзальтолида, это соединение даже при незначительном нагревании источало роскошный запах мускуса.
После этого осталось только окончательно упростить ситуацию и, тем самым, превратить экзотическую изомеризацию в универсальный синтетический прием. Этот шаг - исключение цикла и переход к линейным моделям, разумеется, также был вскоре сделан [45-48], хотя, повторяю, сейчас я просто не понимаю, почему с него не начали.
Вот так, в сущности, на очень простых соединениях и с помощью вполне доступных методов было найдено принципиальное и экспериментально обоснованное решение проблемы существования стабильных циклолов и открыта новая химическая реакция (см. обзорные работы [46-48]). Оставалось придумать ей название.
Я был первым аспирантом у Антонова, и эту ответственную задачу пришлось решать в связи с необходимостью как-то назвать мою диссертацию. Очень горжусь тем, что на ее титульном листе значится "Реакция оксиацильного включения". Споры, как всегда, были долгими, и слово "включение" (incorporation), а не "внедрение" (insertion) выбрали, чтобы новорожденную реакцию никто не спутал с уже известной и отдаленно сходной реакцией Бреннера [49]. Теперь все переименовывают, и включение, говорят, надо называть "гидроксиацильным", но оставим лучше, как было.
* * * А что же все это время делали наши коллеги в Швейцарии? Они в целом прошли тот же путь [50,51], но так уж случилось, что их статьи выходили с опозданием на месяц-другой. Как-то на одном из симпозиумов ко мне подошел бывший сотрудник Гофмана и рассказал, что в те годы ему случалось бывать на грани нервного срыва. Могу только утверждать со всей определенностью, что напряженный темп работы в группе Антонова диктовался исключительно охотничьим азартом; не было и тени того, что американцы называют "крысиными гонками". О том же свидетельствуют и объективные показатели. Самое невинное проявление спешки в научной работе заключается в узости подхода. Вперед, только вперед, ни шагу в сторону! Здесь ситуация была иной - наряду с оксиацильным включением той же маленькой группой интенсивно изучалась химия циклолов и их походя открытых производных: ангидроциклолов, дезоксициклолов, амбидентных катионов... [47,52,53]. Среди этих направлений не могу не упомянуть синтез енольных эфиров ациламидов [54]. Дело в том, что ранее эти необычные соединения были получены в США [55], но американцы так и не сумели разобраться в их строении, приняли за совсем другие вещества, а потом тщетно пытались понять, почему никак не удается разобраться в спектрах [56].
Успех был несомненен, но как-то потом закралась крамольная мысль: ведь если бы мы вообще ничего не делали, то все эти открытия случились бы всего на полгода, ну, на год позже. Я поделился своими размышлениями с В.К., и мы оба отдали должное известному афоризму острого на язык Н.В. Тимофеева-Ресовского: "Никогда не делайте того, что все равно сделают немцы!" Думаю, что все участники этой эпопеи имели повод поразмышлять о превратностях судьбы.
Весьма возможно, впрочем, что на самом деле Гофман и его сотрудники не только не отставали, но даже опережали антоновцев в изучении собственно оксиацильного включения, а с публикациями задержались из-за каких-то проблем с патентованием. Но действительно слабым их местом, по-видимому, оказалось нежелание выйти за рамки эргоалкалоидов и родственных им соединений. Гофман работал в этой области чуть ли не 20 лет (вспомним, именно он - отец LSD!), а нас никакие традиции не сдерживали...
* * * Каждый химик знает, что буря и натиск принципиального этапа уступают далее место не менее важному и продуктивному, но более спокойному периоду "обрастания мясом", который в случае синтетических методов правильнее называть наращиванием мускулатуры. Этот период тоже сложился вполне удачно, и сама по себе красивая реакция оксиацильного включения получила изящное обрамление. Это слово выбрано не случайно, так как самое удачное из ее применений связано с синтезом циклических депсипептидов. Речь идет о серии работ В.К. Антонова и сотр., посвященных "синхронному" включению двух оксикислотных остатков в циклопептиды. Эти исследования начались с выяснения стерических запретов на включение оксикислот в циклодипептиды. На примере ряда N-метилированных оксиацилдипептидов (XXIX-XXXI), сохраняющих еще какое-то, пусть отдаленное, сходство с эргоалкалоидами, было показано, что эта реакция применима для получения 11-членных циклов. Качественно новый результат был получен при переходе к незамещенным циклодипептидам [57,58].
Читателя уже не должно удивить, что превращение бисгликолильного производного (XXXII) останавливается на образовании бисоксациклола. Ясно, что перегруппировка последнего в тетрадепсипептид не может миновать запретный, пространственно затрудненный девятичленный цикл. А вот бис-З-оксипропионилдикетопиперазин (XXXIII) гладко превращается в тетрадепсипептид (XXXIV), с которым, кстати, далее можно повторять процедуры ацилирования и включения много раз, используя при этом остатки альфа- и бета-оксикислот.
* * * Синтез макроциклов вроде (XXXIV-XXXVI) можно было бы расценить как очередной пример тому, что органическая химия подобно математике сама создает себе субстрат исследования. Но неожиданно оказалось, что синхронное включение может послужить незаменимым инструментом при синтезе сложного природного соединения. Работавшая буквально в соседней комнате группа Ю.А. Овчинникова столкнулась с серьезными трудностями при попытке синтеза традиционными методами серратамолида (XXXVIII, X=H) - тетрадепсипептидного антибиотика, продуцируемого чудесной палочкой (Serratia marcescens). Усилия обеих групп были объединены, и вскоре реакция оксиацильного включения нашла свое первое практическое применение [59]. Здесь примечательны два момента. Во-первых, с помощью ацетильных защитных групп пришлось преодолеть конкурирующую миграцию оксиацильных остатков на сериновые гидроксилы (XXXVII р XXXIX р XL; X=H). Во-вторых, это была редкая тогда, а впрочем, и сейчас форма кооперации. Дабы избежать возможных конфликтов и склок при "дележе добычи", участники работы предварительно договорились, что ее результаты не войдут составной частью ни в одну диссертацию!
Ничто не мешало распространить новый подход на синтез пептидов. В результате на свет появилась родственная реакция аминоацильного включения [46,47,60,61]. На примере изомерных превращений З-аланилкапролактама (XLI) видно, что азациклол, возникающий при нуклеофильном присоединении аминогруппы (XLI -->XLII) или при трансанулярной реакции амидных групп (XLIV -->XLII), способен обратимо дегидратироваться в ациламидин (XLIII). Аминоацильное включение до сих пор, к сожалению, никем не использовалось для практического получения пептидов, хотя в некоторых случаях этот синтетический прием явно был к месту.
Пройдет еще несколько лет, и Роте в ФРГ осуществит включение в пептидную цепь тиокислот [62]. Интересно, что перегруппировки, аналогичные реакциям окси- и аминоацильного включения, благополучно протекают и в О-замещенных N-алкилимидах, где обе ациламидные карбонильные группы являются эндоциклическими (например, превращение XLV--> XLVI) [47,63,64]. Разумеется, здесь нет ни возможности, ни необходимости рассказывать о всех исследованиях группы Антонова, связанных с синтезом и изучением свойств стабильных циклолов. Скажу только, что благодаря им открылся путь к ранее недоступным гетероциклическим системам, к соединениям, среди которых исследователь и поныне имеет шанс обнаружить новые физиологически активные вещества [53,65].
* * * Работы оставалось вдоволь, и тем не менее наступил момент, когда она была остановлена. Почему? Таким вопросом может задаться только человек, мало знакомый со стилем М.М. Шемякина. Чувствуя, что сотрудник способен к дальнейшему развитию и далек от потолка своих возможностей, Шемякин всячески стимулировал, а порой просто заставлял его переключаться с углубления былых достижений на решение новых фундаментальных задач. Академик называл это необходимостью пребывать в "кипящем слое"...
Так случилось и с В.К. Антоновым - он приступил к исследованиям механизма действия протеолитических ферментов. Для химика-органика это было смелое решение, однако непрерывность не была нарушена - в конце концов, ортоамидные интермедиаты играют ключевую роль в энзиматическом расщеплении белков. Сегодня мы собрались здесь потому, что выбор Антонова оказался не только смелым, но и удачным.
Что можно добавить к сказанному? В.К. был хорошим человеком. Антонову, быть может, нехватало борцовских качеств, но природная порядочность, сдержанность, полная неспособность к крику и "крутым решениям", умение убеждать, а, при необходимости, с достоинством отступать - все это позволяло ему быть не просто руководителем, но и воспитателем своих сотрудников. Если работу молодого человека уподобить движущемуся экипажу, то Антонов умел в нужный момент быть мотором, сесть за руль, а иной раз и послужить тормозом (без тормоза ведь опасней, чем без мотора!). Для описываемого времени немаловажно, что Антонов и Шемякин как руководители прекрасно дополняли друг друга. Они, мягко говоря, сильно различались темпераментами и манерой поведения и в то же время были едины в понимании сути науки, в полном отсутствии снобизма и в искреннем интересе не только к результатам, но и к самому процессу исследования.
* * * Исследования, о которых шла речь выше, сыграли важную роль в жизни всех участников. Это был их дебют в области химии пептидов и родственных соединений, своего рода полигон, на котором они учились применять идеи и подходы органической химии к биологическим объектам - иными словами, овладевали тем, что составляет подлинную сущность биоорганической химии. Это было непрерывное и взаимное обучение людей, принадлежавших к трем поколениям, и в этом процессе как бы растворялись возрастные и все иные барьеры и возникало ощущение общей причастности к Химии.
Один из лучших рассказов Василия Аксенова называется "Как жаль, что вас не было с нами!". Я уверен, что вместе со мной эти слова повторят все, кто работал тогда с Антоновым: Ц.Е. Агаджанян, Л.А. Андреева, А.И. Иванова, Ю.И. Крылова, А.Г. Лякишева, В.С. Моргулян, Т.Р. Телеснина и незабвенный Владимир Ильич Щелоков, научивший и нас, и Антонова, и Шемякина жизненной мудрости, выраженной всего в двух словах - КЛЕВАЯ ЛАЖА.
Список литературы
1. Шемякин М.М., Чаман Е.С. // ЖОХ. 1955. Т. 25. N 7. С. 1360-1365.
2. Шемякин М.М., Чаман Е.С., Лурье С.И. // Журн. общ. химии. 1955. Т. 25. N 9. С. 1799-1802.
3. Шемякин М.М., Чаман Е.С., Денисова Л.И. // Докл. АН СССР. 1956. Т. 106.
N4. С. 675-678.
4. Шемякин М.М., Денисова Л.И., Чаман Е.С. // Изв. АН СССР, Сер. хим. 1959. N 4. С. 690-694.
5. Шемякин М.М., Антонов В.К. // Докл. АН СССР. 1959. Т. 129. N 2. С. 349-350.
6. Shemyakin M.M., Tschaman E.S., Ravdel G.A., Rodionov W.I. // Bull. Soc. chim. France. 1959. N 3. P. 530-539.
7. Shemyakin M.M. // Angew. Chem. 1960. V. 72. N 10. P. 342-345; Успехи химии. 1962. Т. 31. N 3. С. 269-284.
8. Bender M.L. // J. Amer. Chem. Soc. 1953. V. 75. P. 5986.
9. Bender M.L. // Chem. Rev. 1960. V. 60. N 1. P. 54.
10. Frank F.C. // Nature. 1936. V. 138. P. 242.
11. Wrinch D. // Nature 1957. V. 179. P. 536; 1962. V. 193. P. 245; 1963. V. 199. P. 564 (см. также цит. там работы).
12. Wrinch D. // Chemical Aspects of the Structure of Small Peptides. 1960. E. Munksgaard Publ. Co. Copenhagen.
13. Pauling L.C., Niemann C. // J. Amer. Chem. Soc. 1939. V. 61. P. 1860.
14. Edward J.T. // Research. 1955. V. 8. P. 38.
15. Bernhard S.A. // J. Cell. Comp. Physiol. 1959. V. 54 (Suppl. 1). P. 135.
16. Asahina Y., Ohta T // J. Pharm. Soc. Japan. 1926. V. 53. P. 293.
17. Ohta T. // J. Pharm. Soc. Japan. 1945. V. 65B. P. 89.
18. Chatterjee A., Bose S., Ghosh C. // Tetrahedron. 1959. V. 7. P. 257.
19. Pachter I.J., Suld G. // J. Org. Chem. 1960. V. 25. P. 1680.
20. Pachter I.J., Mohrbacher R.J., Zacharias P. // J. Amer. Chem. Soc. 1961. V. 83. P. 635.
21. Stoll A., Hofmann A., Petrzilka Th. // Helv. chim. acta. 1951. V. 34. P. 1544.
22. Stoll A., Hofmann A. // Helv. chim. acta. 1950. V. 33. P. 1705.
23. Stoll A., Petrzilka Th., Becker B. // Helv. chim. acta. 1950. V. 33. P. 57.
24. Grob C.A., Meier W. // Helv. chim. acta. 1956. V. 39. P. 776.
25. Stoll A., Hofmann A., Leemann H.G., Ott H., Schlenk H.R. // Helv. chim. acta. 1956. V. 39. P. 1165.
26. Green M., Lucken E. // Helv. chim. acta. 1961. V. 44. P. 1417.
27. Antonov V.K., Ravdel G.A., Shemyakin M.M. // Chimia. 1960. V. 14. P. 374.
28. Равдель Г.А., Крит Н.А., Щукина Л.А., Шемякин М.М. // Докл. АН СССР. 1961. Т. 137. С. 1377.
29. Hofmann A., Frey A.J., Ott H. // Experientia. 1961. V. 17. P. 206.
30. Sheppard R.C. // Experientia. 1963. V. 19. P. 125.
31. Shemyakin M.M., Aldanova N.A., Vinogradova E.I., Feigina M.Yu. // Tetrahedron Lett. 1963. N 28. P. 1921-1925.
32. Hoffmann A., Frey A.J., Ott H., Rutschmann H. // Тез. сообщ. на 4-м Европейском симпозиуме по пептидам (Москва, авг. 1961); Журн. Всесоюзн. хим. общ. им. Д.И. Менделеева. 1962. Т. 7. С. 468.
33. Hofmann A., Ott H., Griot R., Stadler P.A., Frey A.J. // Helv. chim. acta 1963. V. 46. P. 2306.
34. Ott H., Frey A.J., Hofmann A.H. // Tetrahedron. 1963. V. 19. P. 1675.
35. Antonov V.K., Shkrob A.M., Shemyakin M.M. // Peptides (Procs of the 6th European Symp. on Peptides, Oxford, Sept. 1962) / Ed. Young G.T. Pergamon Press. 1963. P. 221-228.
36. Shemyakin M.M., Antonov V.K., Shkrob A.M., Sheinker Yu.N., Senyavina L.B. // Tetrahedron Lett. 1962. N 16. P. 701-707.
37. Антонов В.К., Шкроб А.М., Шемякин М.М. // Журн. общ. химии. 1967. Т. 37. N 10. С. 2225-2233.
38. Antonov V.K., Shkrob A.M., Shemyakin M.M. // Tetrahedron Letters. 1963. N 7. P. 439-443.
39. Антонов В.К., Шкроб А.М., Шемякин М.М. // Журн. общ. химии. 1965. Т. 35. N 8. С. 1380-1389.
40. Wieland Th., Urbach H. // Liebig's Ann. Chem. 1958. V. 613. P. 84.
41. Гольдфарб Я.Л., Беленький Л.И. // Успехи химии. 1960. Т. 29. С. 470.
42. Sebenda J., Stehlicek J. // Collect. Czech. Chem. Communs. 1963. V. 28. P. 2731.
43. Sebenda J., Mikulova B. // Collect. Czech. Chem. Communs. 1964. V. 29. P. 738.
44. Антонов В.К., Шкроб А.М., Крылова Ю.И., Шемякин М.М. // Журн. общ. химии. 1966. Т. 36. N 6. С. 1008-1012.
45. Shemyakin M.M., Antonov V.K. // Pure Appl. Chem. 1964. V. 9. N 1. P. 75-94.
46. Shemyakin М.M., Antonov V.K., Shkrob A.M., Shchelokov V.I., Agadzhanyan Z.E. // Tetrahedron. 1965. V. 21. P. 3537-3572.
47. Shemyakin M.M., Antonov V.K. // Acta chim. Hung. 1965. V. 44. N 1-2. P. 93-98.
48.Brenner M., Zimmerman J.P., Wehrmuller J., Quitt P., Hartmann A., Schneider W., Beglinger U. // Helv. chim. acta. 1957. V. 40. P. 1497.
49. Stich K., Leemann H.G. // Helv. chim. acta. 1963. V. 46. P. 1151.
50. Frey A.J., Griot R.G. // Tetrahedron. 1963. V. 19. P. 1161.
51. Шкроб А.М., Крылова Ю.И., Антонов В.К., Шемякин М.М. // Журн. общ. химии. 1965. Т. 35. N 8, С. 1389-1398.
52. Антонов В.К., Андреева Л.И., Лякишева А.Г., Шемякин М.М. // Журн. общ. химии. 1967. Т. 37. N 8, С. 1703-1707.
53. Шкроб А.М., Крылова Ю.И., Антонов В.К., Шемякин М.М. // Изв. АН СССР, Сер. хим. 1964. N 4. С. 774.
54. Hall H.K., Brandt M.K., Mason R.M. // J. Amer. Chem. Soc. 1958. V. 80. P. 6420.
55. Lee C.M., Kumler W.D. // J. Amer. Chem. Soc. 1962. V. 84. P. 565.
56. Antonov V.K., Shkrob A.M., Shchelokov V.I., Shemyakin M.M. // Tetrahedron Lett. 1963. N 21. P. 1353-1360.
57. Антонов В.К., Щелоков В.И., Шемякин М.М. // Изв. АН СССР (сер. хим.). 1963. N 6. С. 1145; Журн. общ. химии. 1965. Т. 35. N 12. 2239-2246.
58. Shemyakin M.M., Ovchinnikov Yu.A., Antonov V.K., Kiryushkin A.A., Ivanov V.T., Shchelokov V.I., Shkrob A.M. // Tetrahedron Lett. 1964. N 1. P. 47-54; Изв. АН СССР, Сер. хим. 1963. N 12. С. 2233.
59. Antonov V.K., Agadzhanyan Ts.E., Telesnina T.R., Dvoryantzeva G.G., Sheinker Yu.N., Shemyakin M.M. // Tetrahedron Lett. 1964. N 13. P. 727-732.
60. Антонов В.К., Агаджанян Ц.Е., Телеснина Т.Р., Шемякин М.М. // Журн. общ. химии. 1965. Т. 35. N 12. С. 2231-2238.
61. Rothe M., Steinberger R. // Angew. Chem. 1968. V. 21. P. 909-910.
62. Glover G.I., Rappoport H. // J. Amer. Chem. Soc. 1964. V. 86. P. 3398.
63. Антонов В.К., Моргулян В.С., Шемякин М.М. // Журн. общ. химии. 1967. Т. 37. N 7. С. 1597-1600.
64. Shkrob A.M., Krylova Yu.I., Antonov V.K., Shemyakin M.M. // Tetrahedron Lett. 1967. N 28. P. 2701-2706; Журн. общ. химии. 1968. Т. 38. N 9. С. 2030-2046, 2046-2050, 2051-2064.
А.М. Шкроб,119571 Москва, ул. 26-ти Бакинских комиссаров
3-3-448
телефон 7-(095)-433-37-09